碳水化合物的分子结构与立体化学
引言:超越线性链的视角
我们首先要彻底摒弃一个观念:葡萄糖在我们的身体里是以教科书上那种笔直的链状结构(费歇尔投影式)存在的。这仅仅是一个用于展示其基本化学组成的二维简化模型。在现实的水环境中(如细胞质),99%以上的葡萄糖都会自发地卷曲成更稳定、更低能量的环状结构。理解这一转变以及由此产生的精细三维结构差异,是掌握碳水化合物一切功能的钥匙。
第一部分:手性的根源 —— 碳水化合物的立体异构
在探讨环状结构之前,我们必须先理解单糖的“不对称性”,即手性(Chirality),相信大家在高中化学中都学习过。
1. 手性碳原子 (Chiral Carbon)
一个碳原子如果连接了四个完全不同的基团,它就是一个手性碳原子。这个碳原子就是分子的“手性中心”,使得该分子无法与其镜像重合,就像你的左手和右手。
在葡萄糖的链状结构中,C2, C3, C4, C5 都是手性碳,而C1(醛基)和C6(-CH₂OH)不是。拥有手性中心是立体异构现象的物理基础。也叫不对称碳原子、不对称中心或手性中心,常用C *表示。有机化合物的旋光性与分子内部的结构有关,根据对称性原理,凡是分子中存在对称面(镜面)、对称中心或四重交替对称轴这些对称元素(symmetry element)之一的,都可以和它的镜像叠合,因而都没有旋光性;凡分子中没有上述三种对称元素的,都不能与它的镜像叠合,因而都有旋光性。分子这种不能与自己的镜像叠合的关系,犹如人的左右手关系,因此称这种分子具有手性或称它为手性分子(chiralmolecule) 。手性与旋光性是一对李生子。
2. 立体异构体 (Stereoisomers) 的层级
立体异构体是指分子式相同、原子连接顺序相同,但原子在空间中的排布不同的化合物。立体异构体分类方法不止一种,这里根据根据三维空间排列关系分类。异构现象除了立体异构还有一种结构异构,这里我们插入一段什么是异构。
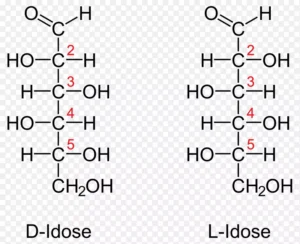
A. 对映异构体 (Enantiomers): D-型与L-型
定义: 互为镜像但不能重合的一对分子。它们所有的物理化学性质(如熔点、沸点、溶解度)都相同,除了与偏振光的相互作用(旋光性)以及与其它手性分子的相互作用(如酶)不同。这里我们引用《生物化学》中的一个图例:
命名规则: 这是我们已经了解的D/L命名法。它严格地只参照离羰基最远的手性碳(对葡萄糖而言是C5)。C5上的-OH在费歇尔投影式中处于右侧,即为D-型(Dextro);在左侧,即为L-型(Levo)。
压倒性的生物学意义: 生命选择了D-糖。所有参与核心能量代谢、构成核酸和细胞结构的糖类几乎都是D-构型。我们的代谢酶的活性位点在三维结构上是高度特异的,就像一把钥匙只能开一把锁,它们被设计成只能精确地结合和催化D-糖的反应。L-糖(如罕见的L-阿拉伯糖)虽然存在于自然界,但不能被我们的主流代谢途径所利用。因此,在我们后续的讨论中,如无特殊说明,默认讨论的都是具有生物学活性的D-型糖。
B. 非对映异构体 (Diastereomers)
定义: 凡是不是对映异构体的立体异构体,都互为非对映异构体。它们不是彼此的镜像。它们的物理和化学性质(熔点、溶解度等)通常是不同的。
例子: D-葡萄糖和D-半乳糖就是一对非对映异构体。它们都是D-型六碳醛糖,但并非镜像关系。
C. 差向异构体 (Epimers): 最细微的差别
定义: 这是一个更精细的分类。如果一对非对映异构体只在一个手性中心的构型上有所不同,那么它们就互为差向异构体。
至关重要的生物学例子:
D-葡萄糖 (Glucose) vs. D-半乳糖 (Galactose): 它们唯一的区别在于C4手性中心的-OH朝向不同。这个看似微小的区别,使得半乳糖不能直接进入糖酵解途径,必须通过专门的“Leloir途径”先把它转化为葡萄糖才能被利用。患有半乳糖血症的婴儿正是因为缺乏这个转化途径中的酶。
D-葡萄糖 (Glucose) vs. D-甘露糖 (Mannose): 它们唯一的区别在于C2手性中心的-OH朝向不同。这个差别同样导致了它们需要不同的代谢酶系。
(图示:比较D-葡萄糖、D-甘露糖和D-半乳糖,可以清晰地看到它们仅在C2或C4一个位点上存在差异)
注:一般在学习立体化学的时候Fisher 投影式是必不可少的,但是其局限性不能忽视,在本章中我们不详细介绍。想要更全面的观测学习可以了解Fisher 投影式 (Fisher Projection)、楔形-短线结构式 (Wedge-and-Dash Structure)、剑桥猴子式 / 球棍模型 (3D Representation / Ball-and-Stick Model)、Haworth 投影式 (Haworth Projection)、椅子构象 (Chair Conformation)、Newman 投影式 (Newman Projection)我们下文会了解椅子构象。
第二部分:水溶液中的真实形态 —— 环化反应
在解释环化反应之前,学习糖的结构和性质是非常有必要的。但是这里我们不细说,这个系列也不会细说。一篇文章得有核心,太散了不好。想要详细了解的参见《生物化学》第一章。
1. 环化机制:分子内的亲核加成
链状的单糖之所以不稳定,是因为其分子内部同时存在一个亲电体(Electrophile,即羰基碳)和一个亲核体(Nucleophile,即羟基氧)。
对于醛糖(如葡萄糖),C5上的羟基氧原子作为亲核体,会攻击C1上带有部分正电荷的醛基碳原子(亲电体)。
电子重新排布,形成一个共价键,羰基的双键打开,捕获一个质子(H⁺),形成一个新的羟基。
这个反应形成了一个环状的半缩醛 (Hemiacetal)。
2. 吡喃环 (Pyranose) 与 呋喃环 (Furanose)
吡喃环: 当C5-OH攻击C1醛基时,形成一个包含5个碳原子和1个氧原子的六元环。这个结构因与化学物质“吡喃 (Pyran)”相似而得名。绝大多数六碳醛糖(如葡萄糖、半乳糖)在溶液中主要以吡喃环形式存在。
呋喃环: 当C4-OH攻击C1醛基时,可以形成一个不太稳定的五元环。更常见的是,在酮糖(如果糖)中,C5-OH攻击C2的酮基,形成一个包含4个碳原子和1个氧原子的五元环。这个结构因与“呋喃 (Furan)”相似而得名。核糖 (Ribose) 和 脱氧核糖 (Deoxyribose) 作为核酸的骨架,也是以呋喃环的形式存在的。
第三部分:环化产生的新异构 —— 异头物 (Anomers)
环化过程是整个碳水化合物化学的核心转折点。
1. 异头碳 (Anomeric Carbon) 的诞生
在链状结构中,C1(醛基碳)不是手性中心。但在环化反应后,它连接了四个不同的基团(-H, -OH, -OR(环内部分), 和C2),因此C1成为了一个新的手性中心。这个新诞生的手性碳被称为异头碳。
2. α-异构体 与 β-异构体
由于异头碳是新的手性中心,新形成的异头羟基(Anomeric Hydroxyl)可以有两种空间朝向,从而产生了两种新的、可以相互转化的立体异构体——异头物 (Anomers)。
命名规则 (哈沃斯投影式中的D-糖):
α-异构体 (alpha): 异头羟基(-OH)的朝向与C6上的-CH₂OH基团相反(一个朝上、一个朝下)。在标准的哈沃斯投影中,α-OH朝下。
β-异构体 (beta): 异头羟基(-OH)的朝向与C6上的-CH₂OH基团相同(都朝上)。在标准的哈沃斯投影中,β-OH朝上。
3. 变旋现象 (Mutarotation)
将纯的α-D-葡萄糖晶体溶于水,其初始比旋光度为+112°。静置一段时间后,比旋光度会逐渐下降,最终稳定在+52.7°。反之,将纯的β-D-葡萄糖(比旋光度+18.7°)溶于水,其比旋光度会逐渐上升,最终也稳定在+52.7°。
解释: 这种旋光度自发变化的过程就是变旋现象。它雄辩地证明了:在溶液中,α-型和β-型可以通过重新变回微量的、不稳定的链状结构,然后再次环化,从而相互转化,直至达到一个动态平衡。
平衡组分: 在31℃的平衡状态下,D-葡萄糖溶液中约含有 64%的β-型,36%的α-型,以及不到1%的链状和呋喃环型。
第四部分:真实的三维构象 —— 椅子式构象
哈沃斯投影式虽然比费歇尔式更进一步,但它仍是一个二维平面化的表示,掩盖了环的真实立体形态。
1. 椅子式构象 (Chair Conformation)
吡喃环不是一个平面六边形。为了使所有碳原子都保持理想的sp³杂化键角(约109.5°),环会发生折叠,形成几种构象,其中能量最低、最稳定的是椅子式构象。
2. 直立键 (Axial) 与 平伏键 (Equatorial)
在椅子式构象中,每个碳原子上的两个取代基(-H和-OH)占据两种位置:
直立键 (Axial): 与环的对称轴大致平行,垂直于环的“平均平面”。
平伏键 (Equatorial): 从环的“腰部”向外伸出,大致平行于环的“平均平面”。
3. 构象的稳定性与β-D-葡萄糖的特殊地位
空间位阻 (Steric Hindrance): 体积较大的取代基(如-OH和-CH₂OH)处于直立键位置时,会与其他直立键上的原子产生空间排斥,导致构象能量升高,变得不稳定。
β-D-吡喃葡萄糖的完美结构: 奇迹般地,在β-D-吡喃葡萄糖的稳定椅子式构象中,所有五个体积较大的取代基(4个-OH和1个-CH₂OH)都恰好处于空间更宽敞的平伏键(Equatorial)位置!
生物学意义: 这使得β-D-葡萄糖成为最稳定、能量最低的六碳糖异构体。这很可能是它被进化选择为生命系统中最核心的能量分子和结构单元(在纤维素中)的根本物理化学原因。相比之下,它的差向异构体(如半乳糖、甘露糖)总会有一个或多个-OH基团被迫处于不太稳定的直立键位置。
第五部分:连接单体 —— 糖苷键 (Glycosidic Bond) 的立体化学
当两个单糖分子连接成双糖或多糖时,形成的化学键就是糖苷键。
1. 形成机制:
一个单糖的异头碳上的半缩醛羟基与另一个分子的羟基(通常是另一个单糖的)发生脱水缩合反应,形成一个缩醛 (Acetal)。这个新的C-O-C键就是糖苷键。
2. 命名与消化:立体化学的决定性作用
糖苷键的命名必须精确反映其立体化学,因为它直接决定了分子的三维形状和生物功能。
α-1,4-糖苷键: 存在于淀粉和糖原中。由α-异头物在C1位与另一个单糖的C4位-OH连接。这种键导致多糖链自然形成螺旋状结构,有利于紧密包装储存能量,并且其暴露的立体构象能被我们的α-淀粉酶识别和水解。
β-1,4-糖苷键: 存在于纤维素中。由β-异头物在C1位与另一个单糖的C4位-OH连接。这种键导致多糖链形成笔直的、扁平的带状结构。这些直链能通过大量的氢键平行排列,形成极其坚韧、不溶于水的微纤维,是植物细胞壁的理想结构材料。我们体内没有能水解β-1,4-糖苷键的酶(纤维素酶)。
3. 还原性末端 (Reducing End)
定义: 在一个寡糖或多糖链中,如果一端的单糖单元还保留着一个自由的异头碳(即其C1-OH未参与形成糖苷键),那么它就可以在溶液中重新打开成链状,暴露出具有还原性的醛基。这一端就称为还原性末端。
例子: 麦芽糖(两个葡萄糖通过α-1,4键连接)有一个还原性末端。
非还原糖:蔗糖 (Sucrose) 是一个特殊的例子。它是由α-葡萄糖和β-果糖通过各自的异头碳(葡萄糖的C1和果糖的C2)连接而成。两个异头碳都被锁定在糖苷键中,没有任何一端可以开环,因此蔗糖是一个非还原糖。
总结:从原子到功能
碳水化合物的生物学功能完全根植于其精密的分子结构和立体化学:
D/L构型 决定了分子能否被生命系统“识别”和利用。
差向异构(Epimerism) 造成了代谢途径的特异性,如葡萄糖与半乳糖的代谢差异。
环化 形成了稳定的吡喃环或呋喃环,是其在水溶液中的真实形态。
α/β异头物(Anomerism) 是最关键的结构差异,直接决定了由同一单体(葡萄糖)构成的多糖是可消化的储能物质(淀粉)还是坚韧的结构材料(纤维素)。
椅子式构象 解释了为何β-D-葡萄糖在热力学上如此稳定,使其成为生命进化的“天选之子”。